小分子化疗药物作为市面上最常见的抗癌药物,具有确定的分子结构和合成路径,在大规模生产方面占据优势。但它们也面临着代谢速度过快、肿瘤富集率低和靶向性差等问题。纳米药物递送系统(Nano Drug Delivery System,NDDS)曾被认为是帮助小分子药物克服这些困难的“黄金策略”。然而,近些年来,一些关于纳米载药的深入研究表明,纳米载体递送药物至活体肿瘤的比例依然很低,平均值在0.7%左右,其中部分原因是纳米载体较低的药物装载率。与此同时,一些纳米材料的合成手段较为复杂,在扩大化实验中可能面临失败风险。
有鉴于此,9001诚信金沙精细化工国家重点实验室彭孝军院士团队孙文教授与荷兰莱顿大学(Leiden University)Sylvestre Bonnet教授团队合作,聚焦于自组装纳米药物体系(Self-assembled nanodrug, SAND),通过合理设计,小分子光敏剂之间可以形成超分子作用力,并在生理环境下聚集为药物装载率可达100%的纳米颗粒,由此克服常规纳米药物递送系统的低药物装载率问题。相关研究成果以“In vivo metallophilic self-assembly of a light-activated anticancer drug”为题,于2023年5月11日发表在Nature Chemistry (2023, DOI: 10.1038/s41557-023-01199-w)上。

该成果验证了一个简单的小分子金属配合物染料是如何利用超分子金属-金属相互作用,在活体内自组装为具有稳定结构的纳米光敏剂,以达到肿瘤的高效富集和光动力抗癌效果。其亮点在于提供了小分子可直接在活体内用做纳米药物的新思路,并将金属-金属相互作用引入纳米医学领域。
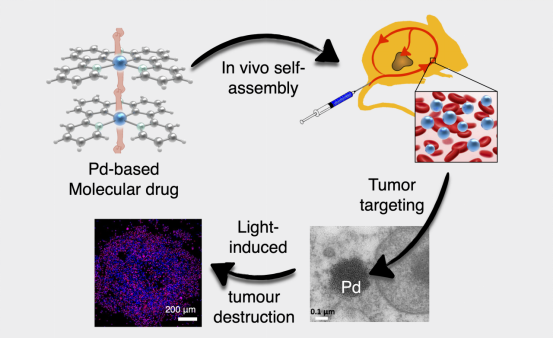
在这项研究工作中,作者们利用了一种非常规的超分子力,即金属-金属相互作用,用于小分子光敏剂自组装。其原因在于,通过引入金属配合物,可以赋予小分子光敏性质,使其在黑暗条件下毒性较低;光照肿瘤部位后,可通过产生活性氧物种,达到物理选择性的抑制肿瘤增长,而不损伤其他部位。作者们设计合成了钯配合物,分别从固态、液态、纳米聚集态、血液自组装等方面,通过单晶衍射、吸收和发射光谱、冷冻电镜、生物电镜等手段,详细研究了这一小分子在金属-金属相互作用、光物理化学和生理环境自组装纳米化等方面的性质。细胞毒性实验和小鼠肿瘤抑制实验也证明了这一金属配合物染料优异的光动力抗癌效果。
进一步研究发现,尾静脉注射12小时后,这一药物依旧以纳米粒的形式富集在肿瘤中,肿瘤富集率可高达10.2% ID/g(即每克肿瘤含有10.2%的注射药物),远高于已报到纳米载体0.7 %ID的平均值。这一研究也证明了金属-金属相互作用具有较强的生物稳定性,可作为一种新的超分子力用于纳米药物开发,值得进一步探索。
论文通讯作者是孙文教授和Sylvestre Bonnet教授,第一作者是Xuequan Zhou博士(目前在意大利Mario Negri药理学研究所从事博士后研究)。论文第一作者单位和第一通讯单位是9001诚信金沙,其他合作单位有荷兰莱顿大学、美国约翰霍普金斯大学、中国科学院福建物质结构研究所,以及意大利Mario Negri药理学研究所。该工作得到了国家自然科学基金优秀青年项目、面上项目和9001诚信金沙星海优青项目的支持。
论文信息:In vivo metallophilic self-assembly of a light-activated anticancer drug, Xue-Quan Zhou, Peiyuan Wang, Vadde Ramu, Liyan Zhang, Suhua Jiang, Xuezhao Li, Selda Abyar, Panagiota Papadopoulou, Yang Shao, Ludovic Bretin, Maxime A. Siegler, Francesco Buda, Alexander Kros, Jiangli Fan, Xiaojun Peng, Wen Sun* & Sylvestre Bonnet*,nature chemistry 2023, 10.1038/s41557-023-01199-w.
论文链接:https://www.nature.com/articles/s41557-023-01199-w